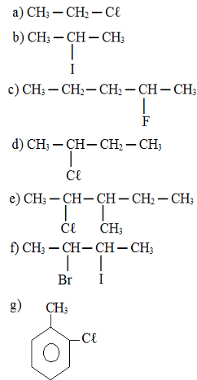Você pode se perguntar o que um televisor tem a ver com Química? A produção de diversos materiais que constituem a televisão depende dos conhecimentos de Química. E isso acontece também com muitos outros produtos presentes em nosso dia a dia, que em cuja composição a ciência está presente. Neste blog você encontrará algumas curiosidades explicadas pela química e muito mais.
Seguidores
Translate
TABELA PERIÓDICA DOS ELEMENTOS

EXPERIMENTOS LOUCOS DE QUÍMICA

terça-feira, 29 de setembro de 2015
terça-feira, 22 de setembro de 2015
segunda-feira, 20 de julho de 2015
ATIVIDADE 6 - JULHO - 3os ANOS
6) " O nome oficial da glicerina, representada na figura a seguir, é ....X...., tratando-se de um ....Y”.


Completa-se corretamente a afirmação acima quando X e Y são substituídos, respectivamente, por:
a) 1, 2, 3- propanotriol e triálcool.
b) álcool propílico e triálcool.
c) propanotrial e trialdeído.
d) éter propílico e poliéter.
e) 1, 2, 3- tripropanol e trialdeído.
ATIVIDADE 5 - JULHO - 3os ANOS
5) Escreva as fórmulas estruturais e dê o nome oficial dos seguintes álcoois:
a) Álcool metílico
b) Álcool etílico
c) Álcool propílico
d) Álcool isopropílico
e) Álcool sec-butílico
f) Álcool terc-butílico
ATIVIDADE 4 - JULHO - 3os ANOS
4) Dê os nomes, segundo as regras estabelecidas pela IUPAC (União Internacional de Química Pura e Aplicada), dos seguintes compostos:


ATIVIDADE 2 - JULHO - 3os ANOS
2) A nomenclatura IUPAC dos compostos abaixo é:
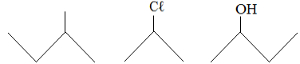
Exercício sobre nomenclatura

Exercício sobre nomenclatura
a) iso-pentano, 2-cloropropano, álcool-sec-butílico.
b) 2-metil-butano, 2-cloro-propano, 2-butanol.
c) iso-pentano, 2-cloro-propil, metil-propil-carbinol.
d) 2-metil-butano, cloreto de isopropila, 2-butanol.
e) isopentil, 2-cloro-propano, álcool butílico.
ATIVIDADE 1 - JULHO - 3os ANOS
1) Os alquenos são obtidos em quantidades industriais principalmente pelo craqueamento (degradação a altas temperaturas) do petróleo. Esses compostos apresentam grandes utilidades como intermediários químicos: "etileno", na síntese do álcool etílico, do óxido de etileno e dos alquenos superiores; "propileno", na síntese do óxido de propileno e 1,2-dicloropropano; e os alquenos (C8─ C12) na obtenção de detergentes. Tricloroetileno e tetracloroetileno são usados em grandes quantidades como solventes para limpeza. As fórmulas estruturais dos três haletos mencionados (1,2-dicloropropano; tricloroetileno e tetracloroetileno), respectivamente, é dada por:
ATIVIDADE OBRIGATÓRIA - JULHO - 3os ANOS
Escreva as fórmulas estruturais dos haletos que possuem as seguintes nomenclaturas:
a) 2-cloropropano
b) bromoeteno
c) 1-iodo-4-metilbenzeno
d) 1,2-dicloroetano
e) clorociclopentano
f) 2-cloro-2-penteno
g) p-bromotolueno
ATIVIDADE 9 - JULHO - 2os ANOS
9) Um técnico de laboratório preparou uma solução aquosa de ácido sulfúrico (H2SO4) misturando 33 g desse ácido em 200 mL de água, com extremo cuidado, lentamente, sob agitação e em uma capela com exaustor. Ao final, a solução ficou com um volume de 220 mL. A concentração em g/L dessa solução é:
a) 0,15
b) 0,165
c) 66
d) 15
e) 150
ATIVIDADE 8 - JULHO - 2os ANOS
8) Complete as lacunas da frase a seguir com os valores corretos:
“Uma solução que apresenta concentração 80 g/L apresenta ... gramas de soluto, por litro da solução. Portanto, em 10 litros dessa solução devem existir ... gramas de soluto.”
ATIVIDADE 7 - JULHO - 2os ANOS
7) Uma solução foi preparada dissolvendo-se 4,0 g de cloreto de sódio (NaCl) em 2,0 litros de água. Considerando que o volume da solução permaneceu 2,0 L, qual é a concentração da solução final?
ATIVIDADE 6 - JULHO - 2os ANOS
6) Adicionando-se soluto a um solvente chega-se a um ponto em que o solvente não mais consegue dissolver o soluto. Neste ponto a solução torna-se:
- Diluída.
- Concentrada.
- Fraca.
- Supersaturada.
- Saturada
ATIVIDADE 5 - JULHO - 2os ANOS
5) Observe a tabela de solubilidade abaixo para várias substâncias:
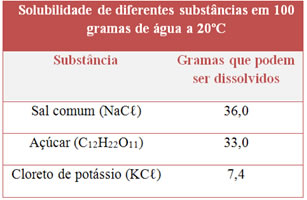

Classifique o tipo de solução (saturada, insaturada ou supersaturada) que obteremos se adicionarmos essas massas de soluto a 100 g de água, à temperatura de 20ºC:
- 50 g de NaCℓ;
- 33,0 g de açúcar;
- 5,0 g de KCℓ.
- Saturada, supersaturada, insaturada.
- Saturada, insaturada, saturada.
- Insaturada, saturada, supersaturada.
- Supersaturada, insaturada, saturada.
- Saturada, saturada, insaturada.
ATIVIDADE 4 - JULHO - 2os ANOS
4) Jaques A. C. Charles, químico famoso por seus experimentos com balões, foi o responsável pelo
segundo vôo tripulado. Para gerar gás hidrogênio, com o qual o balão foi cheio, ele utilizou ferro
metálico e ácido, conforme a seguinte reação:
Fe(s) + H2 SO4(aq) →FeSO4(aq) + H2(g)
Supondo-se que tenham sido utilizados 448kg de ferro metálico; o volume, em litros, de gás hidrogênio
obtido nas CNTP foi de:
Dados: O = 16 g/mol; Fe = 56 g/mol.
a) 89,6 L.
b) 179,2 L.
c) 268,8 L.
d) 89600 L.
e) 179000 L.
segundo vôo tripulado. Para gerar gás hidrogênio, com o qual o balão foi cheio, ele utilizou ferro
metálico e ácido, conforme a seguinte reação:
Fe(s) + H2 SO4(aq) →FeSO4(aq) + H2(g)
Supondo-se que tenham sido utilizados 448kg de ferro metálico; o volume, em litros, de gás hidrogênio
obtido nas CNTP foi de:
Dados: O = 16 g/mol; Fe = 56 g/mol.
a) 89,6 L.
b) 179,2 L.
c) 268,8 L.
d) 89600 L.
e) 179000 L.
ATIVIDADE 3 - JULHO - 2os ANOS
3) O alumínio é obtido pela eletrólise da bauxita (Al2O3 ). Nessa eletrólise, ocorre a formação de oxigênio
que reage com os eletrodos de carbono utilizados no processo. A equação que representa o processo
global é:
2 Al2 O3 + 3 C →_ 3 CO2 + 4 Al
A massa de Al3 O3 consumida na obtenção de 54g de alumínio será, aproximadamente, igual a: Dados: C = 12 u; O = 16 u; Al = 27 u.
a) 25,5g. b) 51,0g. c) 76,5g. d) 102,0g. e) 204,0g.
2 Al2 O3 + 3 C →_ 3 CO2 + 4 Al
A massa de Al3 O3 consumida na obtenção de 54g de alumínio será, aproximadamente, igual a: Dados: C = 12 u; O = 16 u; Al = 27 u.
a) 25,5g. b) 51,0g. c) 76,5g. d) 102,0g. e) 204,0g.
ATIVIDADE 2 - JULHO - 2os ANOS
2) Ácido fosfórico impuro, para uso em preparação de fertilizantes, é produzido pela reação
de ácido sulfúrico sobre rocha de fosfato, cujo componente principal é Ca3(PO4)2. a reação é:
Ca3(PO4)2 (s) + 3 H2 SO4 (aq) → 3 CaSO4 (s) + 2 H3 PO4 (aq)
Quantos mols de H3 PO4 podem ser produzidos pela reação de 200 kg de H2 SO4?
Dados: massas molares (em g/mol): H = 1; O = 16; S = 32; P = 31; Ca = 40.
a) 2107 mol. b) 1361 mol. c) 95,4 mol. d) 954,3 mol. e) 620 mol
Ca3(PO4)2 (s) + 3 H2 SO4 (aq) → 3 CaSO4 (s) + 2 H3 PO4 (aq)
Quantos mols de H3 PO4 podem ser produzidos pela reação de 200 kg de H2 SO4?
Dados: massas molares (em g/mol): H = 1; O = 16; S = 32; P = 31; Ca = 40.
a) 2107 mol. b) 1361 mol. c) 95,4 mol. d) 954,3 mol. e) 620 mol
ATIVIDADE 1 - JULHO - 2os ANOS
1) A combustão completa do metano (CH4) produz dióxido de carbono (CO2) e água. A alternativa que
representa o número de mols de CO2 produzido na combustão de 0,3 mol de CH4 é:
CH4+ 2 O2→ CO2 + 2 H2O
a) 1,2 mols. b) 0,6 mol. c) 0,9 mol. d) 0,3 mol. e) 1,5 mol.
CH4+ 2 O2→ CO2 + 2 H2O
a) 1,2 mols. b) 0,6 mol. c) 0,9 mol. d) 0,3 mol. e) 1,5 mol.
ATIVIDADE OBRIGATÓRIA - JULHO - 2os ANOS
Faça o balanceamento para as equações abaixo:
A) C2H6O + O2 ->
CO2 + H2O
B) Na2CO3 + HCl
-> NaCl + H2O + CO2
C) C6H12O6
-> C2H6O + CO2
D) C4H10 + O2 ->
CO2 + H2O
E) FeCl3 + Na2CO3
-> Fe2(CO3)3 + NaCl
F) NH4Cl +
Ba(OH)2 -> BaCl2 + NH3 + H2O
G) Ca(OH)2 + H3PO4
-> Ca3(PO4)2 + H2O
H) Fe2(CO3)3 + H2SO4
-> Fe2(SO4)3 + H2O + CO2
I) Na2O + (NH4)2SO4
-> Na2SO4 + H2O + NH3
J) FeS2 + O2
-> Fe2O3 + SO2
K) NH3 + O2
-> NO
+ H2O
L) KMnO4 + H2SO4
-> Mn2O7 + K2SO4 + H2O
M) CS2 + O2
->
CO2 + SO2
N) H3PO4 + CaO
-> Ca3(PO4)2 + H2O
O) Na2CO3 + H3PO4
-> Na3PO4 + H2O + CO2
P) KMnO4 -> K2MnO4 + MnO2 + O2
Q) Na
+ KNO3 ->
Na2O + K2O + N2
R)
Ni(CO)4 -> Ni + CO
S) CaC2 + H2O -> C2H2
+
CaO
ATIVIDADE 9 - JULHO - 1os ANOS
9) Qual das equações abaixo está balanceada de forma incorreta:
a) 1 KClO4 → 1 KCl+ 2 O2
b) 2 Fe + 3 H2SO4 → 1 Fe2(SO4)3 + 6 H2
c) 1 C12H22O11 → 12 C + 11 H2O
d) 2 C2H4O + 5 O2 → 4 CO2 + 4 H2O
e) 2 NaHCO3 → 1 Na2CO3 + 1 CO2 + 1 H2O
ATIVIDADE 8 - JULHO - 1os ANOS
8) Considere as equações:
I - Al2O3 + HCl → AlCl3 + H2O
II - SO2 + NaOH → Na2SO3 + H2O
III - BaO4 + HNO3 → Ba(NO3)2 + H2O2 + O2
A sequência correta dos coeficientes dos reagentes e produtos necessários para o balanceamento estequiométrico dessas equações é:
I II III
a) 6,3,3,2 / 1,2,1,1 / 2,1,2,2,2
b) 1,6,2,3 / 2,1,1,1 / 1,1,2,1,1
c) 1,3,3,2 / 2,1,2,2 / 1, 2,1,1,1
d) 6,1,2,3 / 2,1,2,2 / 2,1,2,2,2
e) 1,6,2,3 / 1,2,1,1 / 1, 2,1,1,1
ATIVIDADE 7 - JULHO - 1os ANOS
7) Considerando-se a equação química não balanceada
Mg + HCl → MgCl2 + H2
e admitindo-se, num balanceamento, o coeficiente 6 (seis) para cada produto, o coeficiente de cada reagente será, respectivamente:
a) 3 e 6.
b) 6 e 6.
c) 6 e 12.
d) 12 e 6.
e) 12 e 12.
ATIVIDADE 4 - JULHO - 1os ANOS
4) O cálcio reage com o oxigênio produzindo o óxido de cálcio, mais conhecido como cal virgem. Foram realizados dois experimentos, cujos dados estão alistados na tabela a seguir de forma incompleta:


Descubra o valore de x da Leis de Lavoisier (Lei de Conservação das Massas).
ATIVIDADE 3 - JULHO - 1os ANOS
3) O número de substâncias simples com atomicidade par entre as substâncias O3, H2O2, P4, I2, C2H4, CO2 e He é:
- 5
- 4
- 3
- 2
- 1
ATIVIDADE 2 - JULHO - 1os ANOS
2) Em qual das sequências abaixo estão representados um elemento, uma substância simples e uma substância composta, respectivamente:
- H2, Cℓ2, O2
- H2, Ne, H2O
- H2, HI, He
- H2O, O2, H2
- Cℓ, N2, HI
sexta-feira, 10 de julho de 2015
ATIVIDADE 1 - JULHO -1os ANOS
1) Dê nomes às reações (reação de síntese, decomposição, ou combustão), de acordo com os reagentes e produtos, justificando a resposta:
a) C8H18(g) + 25/2 O2 (g) → 8 CO2(g) + 9 H2O(l)
b) C8H18(g) + 9/2 O2 (g) → 8 C (g) + 9 H2O(l)
c) 2 NaNO3 → 2 NaNO2 + O2
d) N2 + 3 H2 → 2 NH3
segunda-feira, 22 de junho de 2015
ATIVIDADE 6 - JUNHO - 3os ANOS
6) (UFRS) O alcatrão de hulha é uma fonte de:
a) hidrocarbonetos alifáticos.
b) gases combustíveis.
c) óleos comestíveis.
d) compostos aromáticos.
e) hidrocarbonetos alicíclicos.
ATIVIDADE 5 - JUNHO - 3os ANOS
5) (PUC-RIO 2010)
A gasolina é um produto obtido a partir do refinamento do petróleo. Octano e isooctano (2,2,4-trimetilpentano) são dois importantes constituintes da gasolina. Assinale a opção que apresenta a afirmativa INCORRETA.
ATIVIDADE 4 - JUNHO - 3os ANOS
4) Na destilação do petróleo, ao ser aumentada gradativamente a temperatura, são obtidos, sucessivamente:
a) óleo diesel, gasolina, águas amoniacais;
b) gasolina, querosene, óleo diesel;
c) óleos lubrificantes, gasolina, querosene;
d) alcatrão, querosene, águas amoniacais;
e) óleo diesel, gasolina, querosene.
b) gasolina, querosene, óleo diesel;
c) óleos lubrificantes, gasolina, querosene;
d) alcatrão, querosene, águas amoniacais;
e) óleo diesel, gasolina, querosene.
ATIVIDADE 6 - JUNHO - 2os ANOS
6) O inseticida DDT (massa molar = 354,5 g/mol) é fabricado a partir de clorobenzeno (massa molar = 112,5 g/mol) e cloral, de acordo com equação:
C6H5Cl + C2HCl3O –> C14H9Cl5 + H2O
clorobenzeno cloral DDT
clorobenzeno cloral DDT
Partindo-se de uma tonelada (1 t) de clorobenzeno, a massa de DDT produzida é igual a quanto?
ATIVIDADE 5 - JUNHO - 2os ANOS
5) Qual é a quantidade de matéria de gás oxigênio necessária para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g)?
ATIVIDADE 4 - JUNHO - 2os ANOS
4) (Mackenzie-SP)
CH4(g) + O2(g) → CO2(g) + H2O(g)
O volume de CO2 produzido na combustão de 960,0 g de metano, é quanto?
ATIVIDADE 6 - JUNHO - 1os ANOS
6) Faça a associação correta entre as colunas, relacionando a(s) técnica(s) que deve(m) ser empregada(s) para separar os componentes de cada mistura a fim de obter todos os componentes:
Coluna I:
(1) Óleo + água
(2) Álcool + éter
(3) Sal + água
(4) Limalhas de ferro + areia
(5) Areia + cascalho
(6) Ar atmosférico
(7) Sal de cozinha + iodeto de chumbo (insolúvel em água) + água
(8) Óleo + água + sal
(9) Tinta preta
Coluna II:
a) Evaporação
b) Filtração
c) Destilação simples
d) Decantação
e) Destilação fracionada
f) Levigação
g) Decantação e destilação
h) Liquefação
i) Separação magnética
j) Análise cromatográfica ou cromatografia
k) Peneiração ou tamisação
l) Adsorção
ATIVIDADE 5 - JUNHO - 1os ANOS
5) (Cefet-PR) Para um químico, ao desenvolver uma análise, é importante verificar se o sistema com o qual está trabalhando é uma substância pura ou uma mistura. Dependendo do tipo de mistura, podemos separar seus componentes por diferentes processos. Assinale a alternativa que apresenta o método correto de separação de uma mistura.
a) Uma mistura homogênea pode ser separada através de decantação.
b) A mistura álcool e água pode ser separada por filtração simples.
c) A mistura heterogênea entre gases pode ser separada por decantação.
d) Podemos afirmar que, ao separarmos as fases sólidas e líquida de uma mistura heterogênea, elas serão formadas por substâncias puras.
e) O método mais empregado para a separação de misturas homogêneas sólido-líquido é a destilação.
ATIVIDADE 4 - JUNHO - 1os ANOS
4) (Fuvest-SP) Para a separação das misturas: gasolina-água e nitrogênio-oxigênio, os processos mais adequados são respectivamente:
a) decantação e liquefação.
b) sedimentação e destilação.
c) filtração e sublimação.
d) destilação e condensação.
e) flotação e decantação.
ATIVIDADE OBRIGATÓRIA - JUNHO - 2os ANOS
(PUC-MG) Fosgênio, COCl2, é um gás venenoso. Quando inalado, reage com a água nos pulmões para produzir ácido clorídrico (HCl), que causa graves danos pulmonares, levando, finalmente, à morte: por causa disso, já foi até usado como gás de guerra. A equação química dessa reação é:
COCl2 + H2O → CO2 + HCl
Se uma pessoa inalar 198 mg de fosgênio, a massa de ácido clorídrico, em gramas, que se forma nos pulmões, é igual a quanto?
segunda-feira, 8 de junho de 2015
ATIVIDADE 3 - JUNHO - 3os ANOS
3) Indique a afirmação incorreta referente a substância química
acetileno:
a) é um gás utilizado nos maçaricos de solda
b) sua fórmula molecular é C2H4
c) seu nome oficial é etino
d) na combustão total do acetileno, formam-se CO2
e H2O
e) entre os átomos de carbono do acetileno há uma tripla
ligação.
ATIVIDADE 2 - JUNHO - 3os ANOS
2) A substância de fórmula C8H16
representa um:
a) alcano de cadeia aberta
b) alceno de cadeia aberta
c) alcino de cadeia aberta
d) composto aromático
e) alcino de cadeia fechada
ATIVIDADE 1 - JUNHO - 3os ANOS
1) As chamadas “colas de sapateiro” podem causar problemas de saúde não só aos profissionais dessa área, mas, principalmente, às pessoas que as usam como drogas. A cola de sapateiro é rica em compostos aromáticos, entre eles temos o hidrocarboneto aromático tolueno (metilbenzeno); aliás, todos os hidrocarbonetos aromáticos são tóxicos.
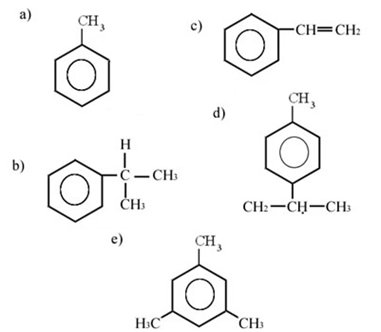
Dos compostos abaixo, qual corresponde ao tolueno?

ATIVIDADE 3 - JUNHO - 2os ANOS
3) Uma mistura gasosa com 0,3 mol de oxigênio, 0,4 mol de nitrogênio e 0,3 mol de argônio exerce uma pressão de 1,12 atmosferas quando encerrada em um recipiente a 273 K. Admitindo-se um comportamento ideal, qual é o volume aproximado, em litros, do recipiente?
(Dados: R = 0,082 atm . L . mol-1 . K-1, N = 14; O = 16; Ar = 40).
ATIVIDADE 2 - JUNHO - 2os ANOS
2) Em uma mistura gasosa de N2, CO2 e H2S, as pressões parciais são, respectivamente, 0,60 atm, 0,90 atm e 1,50 atm. Indique as porcentagens em volume de cada gás na mistura.
a) 30% de N2, 20% de CO2 e 50% de H2S.
b) 50% de N2, 15% de CO2 e 45% de H2S.
c) 20% de N2, 30% de CO2 e 50% de H2S.
d) 80% de N2, 10% de CO2 e 10% de H2S.
e) 25% de N2, 25% de CO2 e 50% de H2S.
ATIVIDADE 1 - JUNHO - 2os ANOS
1) (Vunesp-SP-mod.) Uma mistura gasosa formada por 14,0 g de N2(g) e 8,0 g de O2(g) ocupa um balão com capacidade igual a 30 L, na temperatura de 27ºC. Dadas as massas molares (g/mol) (N2= 28 e O2= 32) e o valor da constante R = 0,082 atm . L . mol-1 . K-1, determine a pressão em atm de cada gás e a pressão total no balão:
Assinar:
Postagens (Atom)